Senin, 16 Mei 2011
Pengelompokan koloid
Macam-macam Koloid
- Aerosol : suatu sistem koloid, jika partikel padat atau cair terdispersi dalam gas. Contoh : debu, kabut, dan awan.
- Sol : suatu sistem koloid, jika partikel padat terdispersi dalam zat cair.
- Emulsi : suatu sistem koloid, jika partikel cair terdispersi dalam zat cair.
- Emulgator : zat yang dapat menstabilkan emulsi dan (Sabun adalah emulgator campuran air dan minyak dan Kasein adalah emulgator lemak dalam air?.
- Gel : koloid liofil yang setengah kaku.
- Gel terjadi jika medium pendispersi di absorbs oleh partikel koloid sehingga terjadi koloid yang agak padat. Larutan sabun dalam air yang pekat dan panas dapat berupa cairan tapi jika dingin membentuk gel yang relatif kaku. Jika dipanaskan akan mencair lagi.
Cara Pembuatan Koloid 2
A. Cara Kondensasi
Cara kondensasi termasuk cara kimia.
kondensasi
Prinsip : Partikel Molekular —————→ Partikel Koloid
Reaksi kimia untuk menghasilkan koloid meliputi :
Prinsip : Partikel Besar ———-→ Partikel Koloid
Cara dispersi dapat dilakukan dengan cara mekanik atau cara kimia:
1.
Cara Mekanik
Cara ini dilakukan dari gumpalan partikel yang besar kemudian dihaluskan dengan cara penggerusan atau penggilingan
2.
Cara Busur Bredig
Cara ini digunakan untak membuat sol-sol logam.
3.
Cara Peptisasi
Cara peptisasi adalah pembuatan koloid dari butir-butir kasar atau dari suatu endapan dengan bantuan suatu zat pemeptisasi (pemecah).
Contoh:
- Agar-agar dipeptisasi oleh air ; karet oleh bensin.
- Endapan NiS dipeptisasi oleh H2S ; endapan Al(OH)3 oleh AlCl3
Cara kondensasi termasuk cara kimia.
kondensasi
Prinsip : Partikel Molekular —————→ Partikel Koloid
Reaksi kimia untuk menghasilkan koloid meliputi :
- Reaksi Redoks
2 H2S(g) + SO2(aq) → 3 S(s) + 2 H2O(l) - Reaksi Hidrolisis
FeCl3(aq) + 3 H2O(l) → Fe(OH)3(s) + 3 HCl(aq) - Reaksi Substitusi
2 H3AsO3(aq) + 3 H2S(g) → As2S3(s) + 6 H2O(l) - Reaksi Penggaraman
Beberapa sol garam yang sukar larut seperti AgCl, AgBr, PbI2, BaSO4 dapat membentuk partikel koloid dengan pereaksi yang encer.
AgNO3(aq) (encer) + NaCl(aq) (encer) → AgCl(s) + NaNO3(aq) (encer)
Prinsip : Partikel Besar ———-→ Partikel Koloid
Cara dispersi dapat dilakukan dengan cara mekanik atau cara kimia:
1.
Cara Mekanik
Cara ini dilakukan dari gumpalan partikel yang besar kemudian dihaluskan dengan cara penggerusan atau penggilingan
2.
Cara Busur Bredig
Cara ini digunakan untak membuat sol-sol logam.
3.
Cara Peptisasi
Cara peptisasi adalah pembuatan koloid dari butir-butir kasar atau dari suatu endapan dengan bantuan suatu zat pemeptisasi (pemecah).
Contoh:
- Agar-agar dipeptisasi oleh air ; karet oleh bensin.
- Endapan NiS dipeptisasi oleh H2S ; endapan Al(OH)3 oleh AlCl3
Cara Pembuatan Koloid
Kondensasi
Merupakan cara kimia. Prinsip umum: Terjadinya kondensasi partikel molekular membentuk partikel koloidKondensasi partikel → koloid
Reaksi kimia untuk menghasilkan koloid meliputi:
™ Reaksi Redoks
2H2S(g) + SO2(aq) → 3S(s) + 2H2O(l)
™ Reaksi Hidrolisis
FeCl3(aq) + 3 H2O(l) → Fe(OH)3(s) + 3 HCl(aq)
™ Reaksi Substitusi/Agregasi Ionik
2H3AsO3(aq) + 3H2S(g) → As2S3(s) + 6 H2O(l)
™ Reaksi Penggaraman
Dispersi
Dapat dilakukan dengan cara mekanik maupun dengan cara kimia.Prinsip umum :
Partikel Besar → Partikel Koloid
Yang termasuk cara dispersi:
Cara Mekanik
Cara ini dilakukan dari gumpalan partikel yang besar kemudian dihaluskan dengan cara penggerusan atau penggilingan.
Cara Busur Bredig
Digunakan untuk membuat sol-sol logam dengan loncatan bunga listrik. Instrument Busur Bredig dapat dilihat pada Gambar 6.12.
™Cara Peptisasi
Cara peptisasi adalah pembutan koloid dari butir-butir kasar atau dari suatu endapan dengan bantuan pemeptisasi (pemecah).
Contoh :
- Agar-agar dipeptisasi oleh air ; Karet oleh bensin.
- Endapan NiS dipeptisasi oleh H2S, Endapan Al(OH)3 olehAlCl3.

Sifat-Sifat Koloid
- Efek Tyndall
Efek tyndall adalah efek yang terjadi jika suatu larutan terkena sinar. Pada saat larutan sejati disinari dengan cahaya, maka larutan tersebut tidak akan menghamburkan cahaya, sedangkan pada sistem koloid, cahaya akan dihamburkan. hal itu terjadi karena partikel-partikel koloid mempunyai partikel-partikel yang relatif besar untuk dapat menghamburkan sinar tersebut. Sebaliknya, pada larutan sejati, partikel-partikelnya relatif kecil sehingga hamburan yang terjadi hanya sedikit dan sangat sulit diamati.
- Gerak Brown
Semakin kecil ukuran partikel koloid, semakin cepat gerak Brown yang terjadi. Demikian pula, semakin besar ukuran partikel koloid, semakin lambat gerak Brown yang terjadi. Hal ini menjelaskan mengapa gerak Brown sulit diamati dalam larutan dan tidak ditemukan dalam campuran heterogen zat cair dengan zat padat (suspensi). Gerak Brown juga dipengaruhi oleh suhu. Semakin tinggi suhu sistem koloid, maka semakin besar energi kinetik yang dimiliki partikel-partikel medium pendispersinya. Akibatnya, gerak Brown dari partikel-partikel fase terdispersinya semakin cepat. Demikian pula sebaliknya, semakin rendah suhu sistem koloid, maka gerak Brown semakin lambat.
- Adsorpsi
- Muatan koloid
- Koagulasi koloid
- Koloid pelindung
- Dialisis
- Elektroforesis
Larutan Buffer
Larutan buffer adalah:
Sifat larutan buffer:
- pH larutan tidak berubah jika diencerkan.
- pH larutan tidak berubah jika ditambahkan ke dalamnya sedikit asam atau basa.
CARA MENGHITUNG LARUTAN BUFFER
| a. | Campuran asam lemah dengan garam dari asam lemah tersebut. Contoh: - CH3COOH dengan CH3COONa - H3PO4 dengan NaH2PO4 |
| b. | Campuran basa lemah dengan garam dari basa lemah tersebut. Contoh: - NH4OH dengan NH4Cl |
- pH larutan tidak berubah jika diencerkan.
- pH larutan tidak berubah jika ditambahkan ke dalamnya sedikit asam atau basa.
CARA MENGHITUNG LARUTAN BUFFER
| 1. | Untuk larutan buffer yang terdiri atas campuran asam lemah dengan garamnya (larutannya akan selalu mempunyai pH < 7) digunakan rumus: [H+] = Ka. Ca/Cg pH = pKa + log Ca/Cg dimana: Ca = konsentrasi asam lemah Cg = konsentrasi garamnya Ka = tetapan ionisasi asam lemah Contoh: Hitunglah pH larutan yang terdiri atas campuran 0.01 mol asam asetat dengan 0.1 mol natrium Asetat dalam 1 1iter larutan ! Ka bagi asam asetat = 10-5 Jawab: Ca = 0.01 mol/liter = 10-2 M Cg = 0.10 mol/liter = 10-1 M pH= pKa + log Cg/Ca = -log 10-5 + log-1/log-2 = 5 + 1 = 6 |
| 2. | Untuk larutan buffer yang terdiri atas campuran basa lemah dengan garamnya (larutannya akan selalu mempunyai pH > 7), digunakan rumus: [OH-] = Kb . Cb/Cg pOH = pKb + log Cg/Cb dimana: Cb = konsentrasi base lemah Cg = konsentrasi garamnya Kb = tetapan ionisasi basa lemah Contoh: Hitunglah pH campuran 1 liter larutan yang terdiri atas 0.2 mol NH4OH dengan 0.1 mol HCl ! (Kb= 10-5) Jawab: NH4OH(aq) + HCl(aq) ® NH4Cl(aq) + H2O(l) mol NH4OH yang bereaksi = mol HCl yang tersedia = 0.1 mol mol NH4OH sisa = 0.2 - 0.1 = 0.1 mol mol NH4Cl yang terbentuk = mol NH40H yang bereaksi = 0.1 mol Karena basa lemahnya bersisa dan terbentuk garam (NH4Cl) maka campurannya akan membentuk Larutan buffer. Cb (sisa) = 0.1 mol/liter = 10-1 M Cg (yang terbentuk) = 0.1 mol/liter = 10-1 M pOH = pKb + log Cg/Cb = -log 10-5 + log 10-1/10-1 = 5 + log 1 = 5 pH = 14 - p0H = 14 - 5 = 9 |
Kimia & Lingkungan 2
Peran ilmu kimia sangat banyak dalam kehidupan. Marilah kita bahas beberapa peran ilmu kimia untuk kemajuan yang lebih baik. Peran ilmu kimia adalah sebagai berikut.
1. Mempelajari sifat dan fungsi bahan kimia dalam lingkungan hidup
 Beberapa contoh bahan kimia, baik yang merupakan komponen yang alami lingkungan hidup dan ada pula yang merupakan hasil aktivitas manusia yang berlebihan. Setiap bahan memiliki sifat fisika dan sifat kimia serta fungsi yang berbeda-beda. Sebagai contoh oksigen yang berupa gas tak berwarna, gas ini tak beracun dan sangat diperlukan oleh manusia, hewan, dan bakteri aerobik untuk bernafas. Bila ditinjau secara kimia dari segi molekulnya, oksigen memiliki ikatan rangkap dua dengan bentuk molekul planar,dan dapat mengoksidasi besi (terjadinya perkaratan).
Beberapa contoh bahan kimia, baik yang merupakan komponen yang alami lingkungan hidup dan ada pula yang merupakan hasil aktivitas manusia yang berlebihan. Setiap bahan memiliki sifat fisika dan sifat kimia serta fungsi yang berbeda-beda. Sebagai contoh oksigen yang berupa gas tak berwarna, gas ini tak beracun dan sangat diperlukan oleh manusia, hewan, dan bakteri aerobik untuk bernafas. Bila ditinjau secara kimia dari segi molekulnya, oksigen memiliki ikatan rangkap dua dengan bentuk molekul planar,dan dapat mengoksidasi besi (terjadinya perkaratan).
2.Mempelajari dan menelaah pengaruh bahan kimia terhadap suatu komponen lain dan terhadap lingkungan hidup secara keseluruhan, terutama jika bahan kimia itu tersebar dan berkontaminasi dengan lingkungan sehingga keseimbangan terganggu.
Dengan mempelajari dan menelaah kita akan mengetahui bahwa bahan kimia yang tidak beracun dan sangat amanpun dapat menimbulkan masalah lingkungan apabila bahan tersebut tersebar. Sebagai contoh, karbohidrat apabila tersebar dari limbah restoran atu rumah tangga dapat menimbulkan polusi udara (bau busuk). Karbon dioksida yang tidak beracun, akan dapat memicu efek rumah kaca (pemanasan global).
Selain itu dengan mempelajari dan menelaah kita akan dapat mengetahui bagaimana kondisi lingkungan kita dengan adanya kontak dengan bahan kimia terutama bahan kimia pencemar.
3. Menentukan jumlah batas penyebaran bahan kimia dalam lingkungan agar tidak memberikan gangguan terhadap kelestarian lingkungan dan kesejahteraan manusia.
Selama ini digunakan nilai ambang batas (NAB) atau nilai toleransi lingkungan dan manusia terhadap bahan kimia, dimana yang menjadi ukuran adalah status kesehatan masyarakat usia produktif dan daya lenting lingkungan. Dalam NAB tersebut terdapat jumlah maksimal bahan kimia dalam lingkungan, dimana pada jumlah tersebut bahan kimia yang dimaksud tidak akan berdampak negatif terhadap lingkungan. Selain itu juga sering dilakukan pertemuan secara internasional mengenai nilai standar bahan kimia di lingkungan , sebagai contoh Euro-2 yang menentukan standat emisi kendaran.
4. Merekomendasikan hasil penelitian dan percobaan kepada pengelola lingkungan hidup atau kepada masyarakat pada umumnya.
Dari hasil penelitian akan diperoleh data mengenai keadaan lingkungan saat ini. Sebagai contoh penelitian yang dilakukan Japan Automobile Research Institute (JARI yang menunjukkan pencemaran oleh timbal paling berat terjadi di Jakarta ketimbang Tokyo, Beijing, Seoul, Taipei, Bangkok, Kuala Lumpur, dan Manila. Dampak yang diakibatkan pencemaran timbal bisa menyebabkan kematian, kemandulan, dan keterbelakangan mental pada anak- anak. Pencemaran udara di Jakarta 80 persen berasal dari sektor transportasi, sisanya pencemaran dari sektor industri dan lain- lain. Dan hal tersebut sudah disamapaikan di dalam sebuah diskusipada awal Agustus 2006 yang diselenggarakan Mitra Emisi Bersih (MEB) di Jakarta,sehingga sudah saatnya Jakarta menerapkan standar emisi berdasarkan standar Euro-2. (soera)
1. Mempelajari sifat dan fungsi bahan kimia dalam lingkungan hidup
 Beberapa contoh bahan kimia, baik yang merupakan komponen yang alami lingkungan hidup dan ada pula yang merupakan hasil aktivitas manusia yang berlebihan. Setiap bahan memiliki sifat fisika dan sifat kimia serta fungsi yang berbeda-beda. Sebagai contoh oksigen yang berupa gas tak berwarna, gas ini tak beracun dan sangat diperlukan oleh manusia, hewan, dan bakteri aerobik untuk bernafas. Bila ditinjau secara kimia dari segi molekulnya, oksigen memiliki ikatan rangkap dua dengan bentuk molekul planar,dan dapat mengoksidasi besi (terjadinya perkaratan).
Beberapa contoh bahan kimia, baik yang merupakan komponen yang alami lingkungan hidup dan ada pula yang merupakan hasil aktivitas manusia yang berlebihan. Setiap bahan memiliki sifat fisika dan sifat kimia serta fungsi yang berbeda-beda. Sebagai contoh oksigen yang berupa gas tak berwarna, gas ini tak beracun dan sangat diperlukan oleh manusia, hewan, dan bakteri aerobik untuk bernafas. Bila ditinjau secara kimia dari segi molekulnya, oksigen memiliki ikatan rangkap dua dengan bentuk molekul planar,dan dapat mengoksidasi besi (terjadinya perkaratan).2.Mempelajari dan menelaah pengaruh bahan kimia terhadap suatu komponen lain dan terhadap lingkungan hidup secara keseluruhan, terutama jika bahan kimia itu tersebar dan berkontaminasi dengan lingkungan sehingga keseimbangan terganggu.
Dengan mempelajari dan menelaah kita akan mengetahui bahwa bahan kimia yang tidak beracun dan sangat amanpun dapat menimbulkan masalah lingkungan apabila bahan tersebut tersebar. Sebagai contoh, karbohidrat apabila tersebar dari limbah restoran atu rumah tangga dapat menimbulkan polusi udara (bau busuk). Karbon dioksida yang tidak beracun, akan dapat memicu efek rumah kaca (pemanasan global).
Selain itu dengan mempelajari dan menelaah kita akan dapat mengetahui bagaimana kondisi lingkungan kita dengan adanya kontak dengan bahan kimia terutama bahan kimia pencemar.
3. Menentukan jumlah batas penyebaran bahan kimia dalam lingkungan agar tidak memberikan gangguan terhadap kelestarian lingkungan dan kesejahteraan manusia.
Selama ini digunakan nilai ambang batas (NAB) atau nilai toleransi lingkungan dan manusia terhadap bahan kimia, dimana yang menjadi ukuran adalah status kesehatan masyarakat usia produktif dan daya lenting lingkungan. Dalam NAB tersebut terdapat jumlah maksimal bahan kimia dalam lingkungan, dimana pada jumlah tersebut bahan kimia yang dimaksud tidak akan berdampak negatif terhadap lingkungan. Selain itu juga sering dilakukan pertemuan secara internasional mengenai nilai standar bahan kimia di lingkungan , sebagai contoh Euro-2 yang menentukan standat emisi kendaran.
4. Merekomendasikan hasil penelitian dan percobaan kepada pengelola lingkungan hidup atau kepada masyarakat pada umumnya.
Dari hasil penelitian akan diperoleh data mengenai keadaan lingkungan saat ini. Sebagai contoh penelitian yang dilakukan Japan Automobile Research Institute (JARI yang menunjukkan pencemaran oleh timbal paling berat terjadi di Jakarta ketimbang Tokyo, Beijing, Seoul, Taipei, Bangkok, Kuala Lumpur, dan Manila. Dampak yang diakibatkan pencemaran timbal bisa menyebabkan kematian, kemandulan, dan keterbelakangan mental pada anak- anak. Pencemaran udara di Jakarta 80 persen berasal dari sektor transportasi, sisanya pencemaran dari sektor industri dan lain- lain. Dan hal tersebut sudah disamapaikan di dalam sebuah diskusipada awal Agustus 2006 yang diselenggarakan Mitra Emisi Bersih (MEB) di Jakarta,sehingga sudah saatnya Jakarta menerapkan standar emisi berdasarkan standar Euro-2. (soera)
Kimia dan Lingkungan
Kimia lingkungan

Hutan mengandung hal-hal yang dipelajari oleh kimia lingkungan
Kimia lingkungan pertama kali mempelajari bagaimana cara kerja lingkungan yang tak terkontaminasi, zat kimia apa dan berapa konsentrasi yang ada secara alami, dan apa efeknya. Tanpa hal ini, mustahil untuk mempelajari secara akurat efek manusia terhadap lingkungan dengan pelepasan zat kimia.
Simbol Non Unsur
Non unsur, khususnya dalam kimia organik dan organometalik, seringkali menggunakan simbol yang terinspirasi oleh simbol-simbol unsur kimia. Berikut adalah contohnya:
Cy - sikloheksil; Ph - fenil; Bz - benzoil; Bn - benzil; Cp - Siklopentadiena; Pr - propil; Me - metil; Et - etil; Tf - triflat; Ts - tosil; Hb - hemoglobin.
Kelimpahan
Cy - sikloheksil; Ph - fenil; Bz - benzoil; Bn - benzil; Cp - Siklopentadiena; Pr - propil; Me - metil; Et - etil; Tf - triflat; Ts - tosil; Hb - hemoglobin.
Kelimpahan
| Unsur | Ppm (w/w) |
|---|---|
| Hidrogen | 739,000 |
| Helium | 240,000 |
| Oksigen | 10,400 |
| Karbon | 4,600 |
| Neon | 1,340 |
| Besi | 1,090 |
| Nitrogen | 960 |
| Silikon | 650 |
| Magnesium | 580 |
| Sulfur | 440 |
| Kalium | 210 |
| Nikel | 100 |
Lambang kimia
Sebelum kimia menjadi bidang ilmu, ahli alkemi telah menentukan simbol-simbol baik untuk logam maupun senyawa umum lainnya. Mereka menggunakan singkatan dalam diagram atau prosedur; dan tanpa konsep mengenai suatu atom bergabung untuk membentuk molekul. Dengan perkembangan teori zat, John Dalton memperkenalkan simbol-simbol yang lebih sederhana, didasarkan oleh lingkaran, yang digunakan untuk menggambarkan molekul.
Sistem yang saat ini digunakan diperkenalkan oleh Berzelius. Dalam sistem tipografi tersebut, simbol kimia yang digunakan adalah singkatan dari nama Latin (karena waktu itu Bahasa Latin merupakan bahasa sains); misalnya Fe adalah simbol untuk unsur ferrum (besi), Cu adalah simbol untuk unsur Cuprum (tembaga), Hg adalah simbol untuk unsur hydrargyrum (raksa), dan sebagainya.
Simbol kimia digunakan secara internasional, meski nama-nama unsur diterjemahkan antarbahasa. Huruf pertama simbol kimia ditulis dalam huruf kapital, sedangkan huruf selanjutnya (jika ada) ditulis dalam huruf kecil.
Sistem yang saat ini digunakan diperkenalkan oleh Berzelius. Dalam sistem tipografi tersebut, simbol kimia yang digunakan adalah singkatan dari nama Latin (karena waktu itu Bahasa Latin merupakan bahasa sains); misalnya Fe adalah simbol untuk unsur ferrum (besi), Cu adalah simbol untuk unsur Cuprum (tembaga), Hg adalah simbol untuk unsur hydrargyrum (raksa), dan sebagainya.
Simbol kimia digunakan secara internasional, meski nama-nama unsur diterjemahkan antarbahasa. Huruf pertama simbol kimia ditulis dalam huruf kapital, sedangkan huruf selanjutnya (jika ada) ditulis dalam huruf kecil.
kimia menurut wikipedia
Unsur kimia.
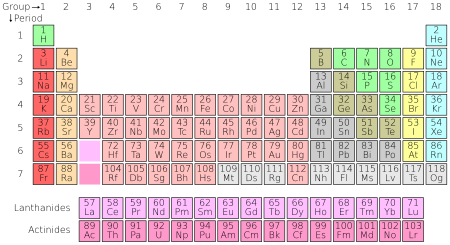
Tabel periodik unsur kimia
Langganan:
Komentar (Atom)
